PPT LEYES DE LOS GASES PERFECTOS Tema 8 Física y Química 3º Diversificación PowerPoint

Leyes de los gases. Las primeras leyes de los gases fueron desarrolladas desde finales del siglo XVII, cuando los científicos empezaron a darse cuenta de que en las relaciones, entre la presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería válida para todos los gases.
LEYES DE LOS GASES by rosaliagarciac Issuu

Es decir, la fugacidad de una sustancia en su hipotético estado estándar ideal-gas, fA(HIGo), es una constante cuyo valor es de 1 bar. (Si queremos expresar fugacidad en unidades de, digamos, pascales, entonces) Po = fA(HIGo) = 105 Pa. Podemos calcular la fugacidad de un gas real, a presión P y temperatura T, a partir de.
Leyes de los Gases YouTube

A continuación encontrarás ejemplos de utilización de cada ley de los gases en los cálculos. Observa que la temperatura se mide en K, la presión se mide en N / m 2 y el volumen se mide en m 3. Asigna variables a cada propiedad del ejemplo como V1, P2, T1, etc. Esto te ayudará a introducir fácilmente los valores en la ecuación correcta.
PPT Los gases PowerPoint Presentation, free download ID3134239

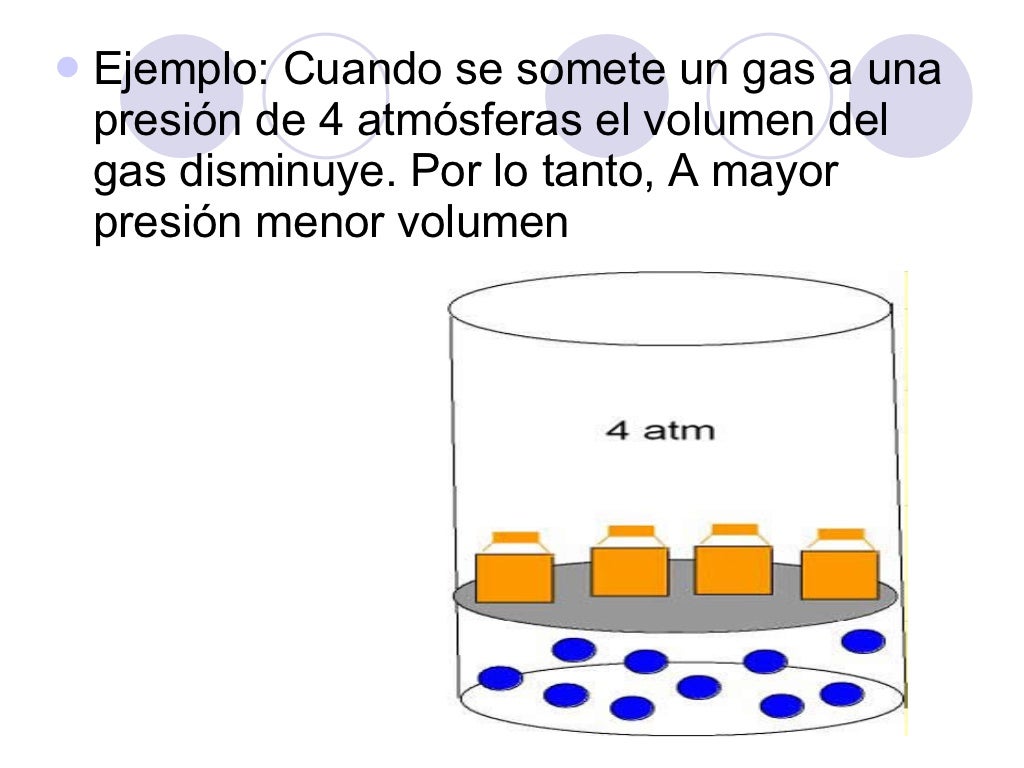
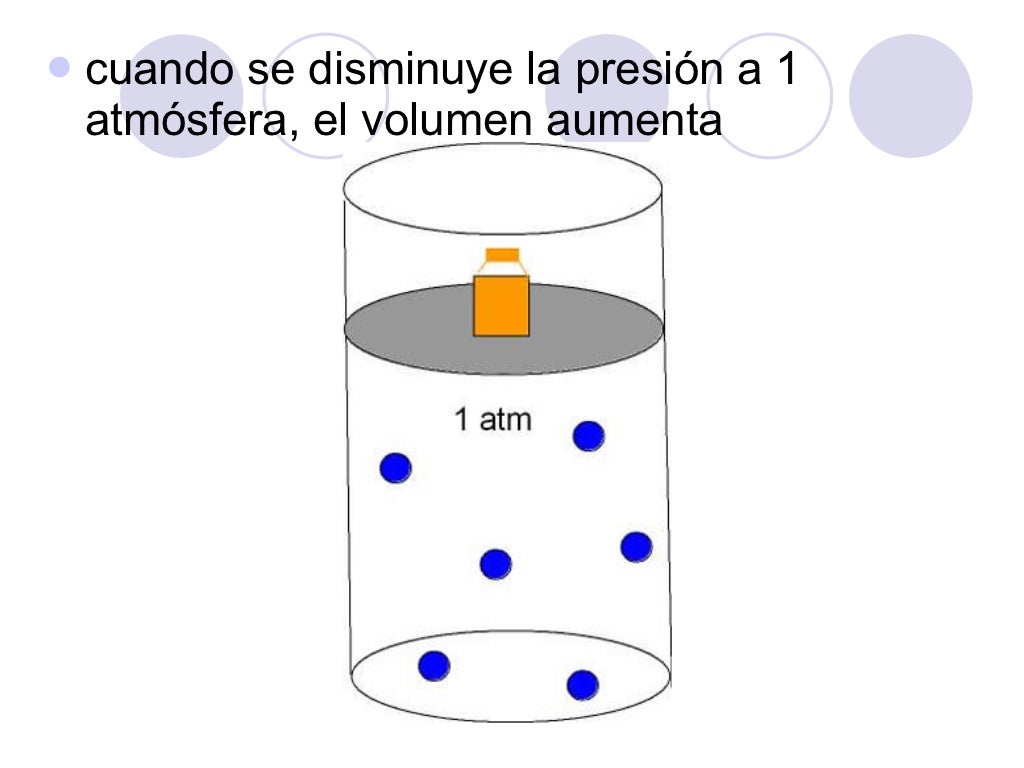
Ley de Boyle-Mariotte. A temperatura constante, el volumen ocupado por una masa de gas es inversamente proporcional a la presión que ejerce. p 1 es la presión inicial. V 1 es el volumen inicial. p 2 es la presión final. V 2 es el volumen final. Ley de Boyle-Mariotte. Al aumentar la presión, disminuye el volumen.
Gases Ideales Ley de los gases ideales

Aprende. Ley de los gases ideales (PV = nRT) Ejemplo resuelto: uso de la ley de gases ideales para calcular el número de moles. Ejemplo resuelto: uso de la ley de gases ideales para calcular un cambio en volumen. Ecuación de los gases ideales. Ejemplo 2. Ecuación de gas ideal.
PPT LEYES DE LOS GASES PowerPoint Presentation, free download ID4136219

Ley de los gases ideales. La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos ( conservación de momento y energía cinética ). La energía cinética es directamente proporcional a la.
CIENCIA Y TECNOLOGÍA FÍSICA Leyes de los gases
V 1 = 22,4 L V 2 = 89,6 L. Proceso a presión y temperatura constante. Por la ley de Avogadro. n1 V1 = n2 V2. n 2 = n1 × V2 V1. n 2 = 1 × 89, 6 22, 4 = 4mol. Entre las leyes de los gases ideales tenemos la ley de Boyle, Charles, Lussac, Avogadro, ley general , ecuación universal. Fórmulas, ejemplos y ejercicios resueltos.
Teoria Cinético Molecular FÍSICA Y QUÍMICA 2º ESO

A veces, coloquialmente nos referimos a esta ley como una de acción-reacción, donde la fuerza ejercida es la acción y la fuerza experimentada como consecuencia es la reacción. Podemos ver de inmediato a la tercera ley de Newton en acción al mirar cómo se mueve la gente. Considera una nadadora que se empuja de la pared de una piscina, como.
Leyes De Los Gases
La tercera ley y la fugacidad de un gas puro y real. En el Capítulo 11, se introduce la fugacidad como medida de la diferencia entre la energía molar libre de Gibbs de un gas real \(P\), \(\overline{G}\left(P,T\right)\) a presión, y la del gas puro en su hipotético estado estándar de gas ideal a la misma temperatura. Elegimos la energía libre de formación estándar de Gibbs \({\Delta.
Ley general de los gases explicación y ejercicios resueltos GASES Química y Física YouTube

La ley de los gases ideales, también llamada ecuación general de los gases, es la ecuación de estado de un gas ideal hipotético. Es una buena aproximación del comportamiento de muchos gases bajo muchas condiciones, aunque tiene varias limitaciones. Fue declarado por primera vez por Benoît Paul Émile Clapeyron en 1834 como una.
Leyes de los gases.ppt Mole (Unidad) Gases

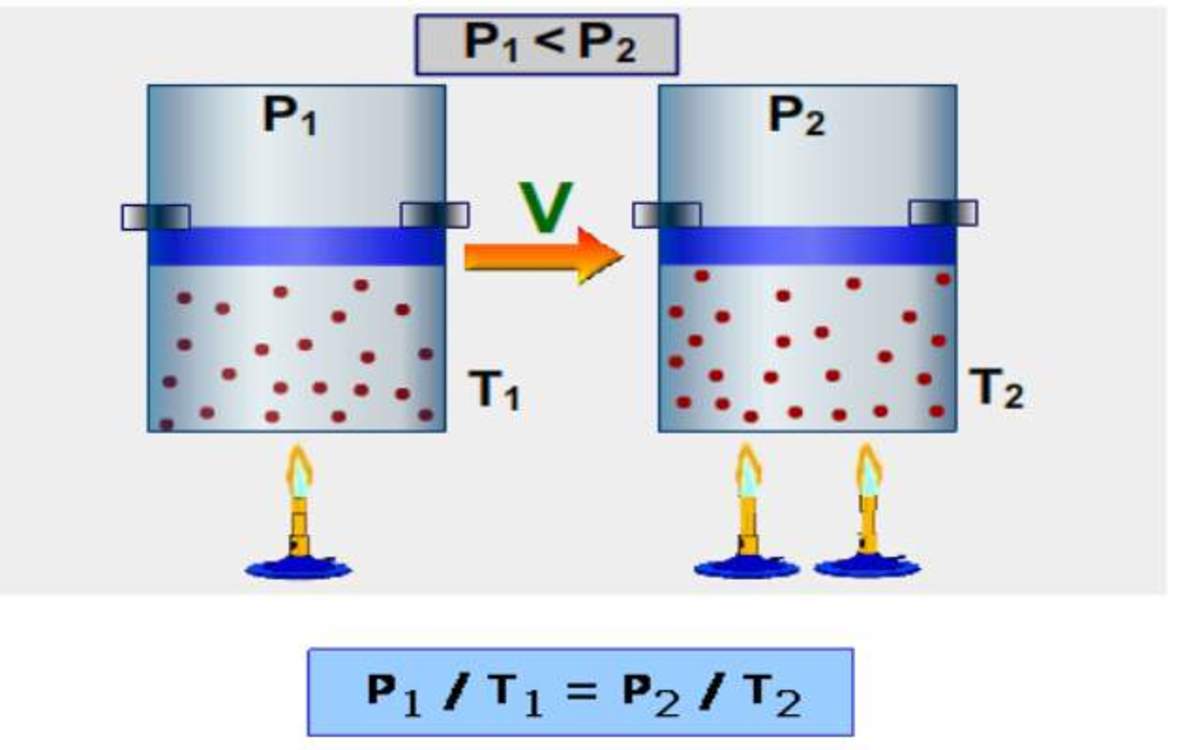
Esta ley combinada de los gases trata con una cantidad fija de gas. La ecuación de la ley combinada de los gases se puede usar cuando la presión, la temperatura y el volumen de un gas están cambiando: PAGS 1 V 1 / T 1 = PAGS 2 V 2 / T 2. "P 1 " es la presión inicial del gas. "V 1 " es el volumen inicial del gas.
LEYES DE LOS GASES leyes de los gasespgm
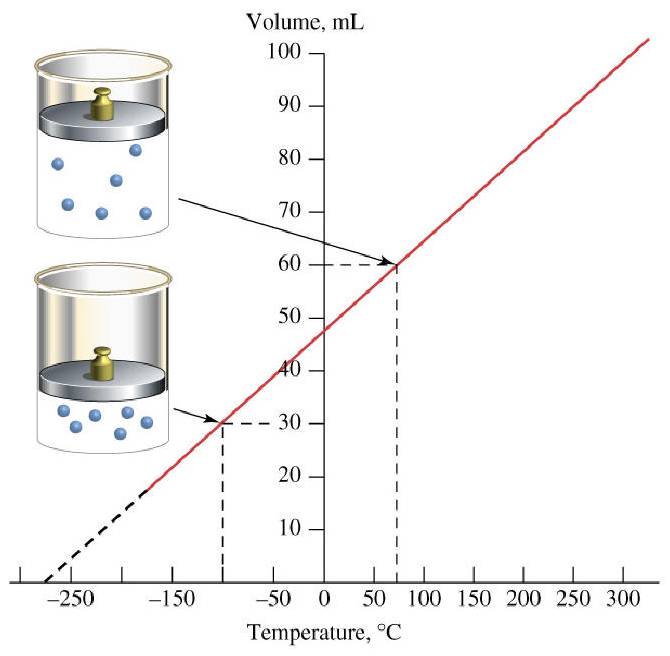
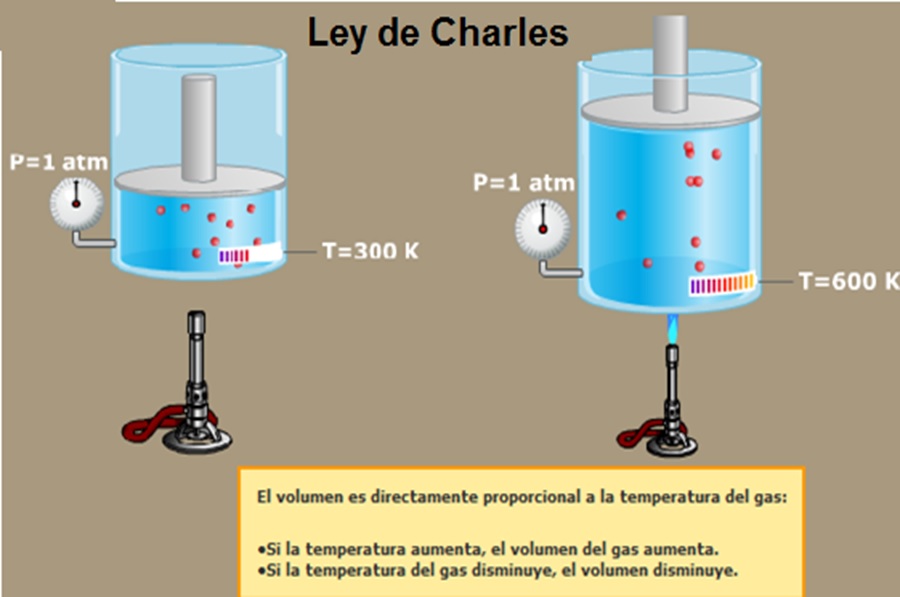
Se conoce como ley de Charles o ley de los volúmenes, descubierta en el año 1787. La ley asegura que si se mantiene una presión constante sobre este gas ideal, entonces el volúmen que mantenga va a ser proporcional a esa temperatura absoluta.Es decir que si aumenta la temperatura, entonces el gas también aumenta.
Leyes De Los Gases
Ecuación de la ley de los gases ideales. Todas las propiedades de un gas ideal se resumen en una fórmula: p V = n R T pV = nRT. donde: V V - volumen del gas, medido en m 3. n n - cantidad de sustancia, medida en moles. R R - constante de los gases ideales. T T - temperatura del gas, medida en kelvin.
El Rincón Atomista Leyes de los gases
¡Buenos días Amigos de la Química!Empezamos con las leyes de los gases: - ley de Boyle-Mariotte, - ley de Charles y - ley de Gay-Lussac. En este víde.
Comportamiento de los gases. La teoria cinética molecular
11.3: La Tercera Ley. Para la entropía por otro lado, el hecho de que la capacidad calorífica vaya a cero a medida que disminuye la temperatura tiene consecuencias importantes. Considera el cambio en la entropía de una sustancia pura cuya capacidad calorífica se aproxima a algún valor limitante finito a medida que su temperatura disminuye.
LEYES DE LOS GASES IDEALES

Fórmula. Partiendo de la ecuación del estado: P·V= n·R·T. Tenemos que: Donde R es la constante universal de los gases ideales, luego para dos estados del mismo gas, 1 y 2: Forma común: La ecuación normalmente describe la relación entre la presión, el volumen, la temperatura y la cantidad (en moles) de un gas ideal y se expresa así: PV.